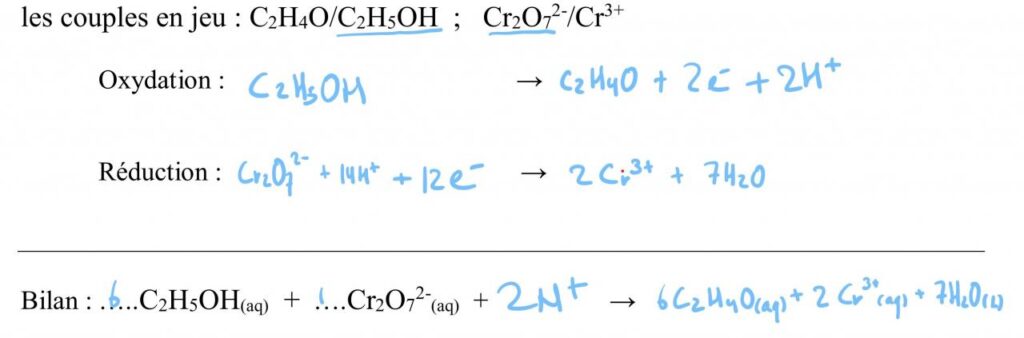Le chrome est un élément chimique dont le symbole est Cr et le numéro atomique 24. Le nombre d’oxydation du chrome est une mesure utilisée pour décrire l’état d’oxydation de l’atome de chrome. Il est défini comme le nombre de charges positives ou négatives qu’un atome de chrome peut acquérir.
Le chrome est un métal de transition qui peut se lier à des ions oxygène pour former des ions chromique. Il peut également se lier à des ions hydrogène pour former des ions chromhydrates. Le chrome se trouve dans la nature sous forme d’ions chromiques, avec un nombre d’oxydation +3. Il existe également des composés du chrome qui ont des nombres d’oxydation différents.
Le nombre d’oxydation du chrome peut varier de -2 à +6. Les degrés d’oxydation les plus communs du chrome sont +2, +3 et +6. Le degré d’oxydation +3 est le plus stable, les états +4 et +5 étant relativement rares. Les états +1 et +2 sont des états instables et sont généralement obtenus par réduction.
Quels sont les degrés d’oxydation les plus communs du chrome ?
Le degré d’oxydation le plus commun du chrome est +3. Cet état est stable et est le plus commun dans la nature. Il est généralement formé par l’oxydation de l’ion chromate. Les ions chromate sont des ions qui ont un nombre d’oxydation +6 et qui sont formés par l’oxydation de l’ion chromite.
L’ion chromite est un ion qui a un nombre d’oxydation +2 et qui est formé par la réduction de l’ion chromate. Les ions chromite sont également stables et sont couramment trouvés dans la nature.
Le degré d’oxydation +4 est rare et se trouve principalement dans des composés du chrome qui sont formés par l’oxydation de l’ion chromite. Ces composés sont généralement instables et ne sont pas couramment trouvés dans la nature.
Le degré d’oxydation +5 est très rare et se trouve principalement dans des composés du chrome qui sont formés par l’oxydation de l’ion chromite. Ces composés sont généralement très instables et ne sont pas couramment trouvés dans la nature.
Quels sont les effets du chrome(VI) et du chrome(II) ?
Le chrome(VI) est un puissant oxydant et est très réactif. Il est généralement trouvé sous forme d’ions chromates ou de composés du chrome tels que le chlorochromate de pyridinium ([C5H5NH][CrO3Cl]). Les composés du chrome(VI) sont très puissants oxydants et peuvent provoquer des réactions de substitution et d’addition.
Le chrome(II) est un réducteur et est relativement peu réactif. Il est généralement trouvé sous forme d’ions chromite ou de composés du chrome tels que le dichromate de potassium ([K2Cr2O7]). Les composés du chrome(II) sont relativement peu réactifs et sont principalement utilisés pour la réduction des composés organiques.
Le chrome(VI) et le chrome(II) sont des composés très réactifs et peuvent provoquer des réactions chimiques dangereuses. Il est donc important de les manipuler avec précaution et de les utiliser uniquement dans des conditions contrôlées.
Conclusion
Le nombre d’oxydation du chrome est une mesure utilisée pour décrire l’état d’oxydation de l’atome de chrome. Il peut varier de -2 à +6, les degrés d’oxydation les plus communs étant +2, +3 et +6. Les composés du chrome(VI) sont des oxydants puissants, tandis que les composés du chrome(II) sont des réducteurs. Il est important de manipuler le chrome et ses composés avec précaution et de les utiliser uniquement dans des conditions contrôlées.